Dãy hoạt động hóa học của kim loại bao gồm một dãy các kim loại mà dựa vào mức độ hoạt động của nó người ta sẽ sắp xếp theo thứ tự giảm dần. Dãy hoạt động hóa học của kim loại được hình thành thông qua việc thực hiện nhiều thí nghiệm hóa học khác nhau. Dựa vào dãy hoạt động này, chúng ta sẽ dễ dàng dự đoán được khi một kim loại phản ứng với các chất khác sẽ như thế nào. Dưới đây là cách để các em học sinh lớp 9 hiểu rõ hơn về ý nghĩa và cách học thuộc lòng dãy hoạt động hóa học của kim loại.
Các học thuộc lòng dãy hoạt động hóa học của kim loại lớp 9 dễ nhất

Nếu chỉ dùng kí hiệu hóa học sẽ rất khó để ghi nhớ dãy hoạt động hóa học của kim loại.
Tuy nhiên, bằng cách dưới đây các em học sinh sẽ dễ dàng học thuộc lòng hơn:
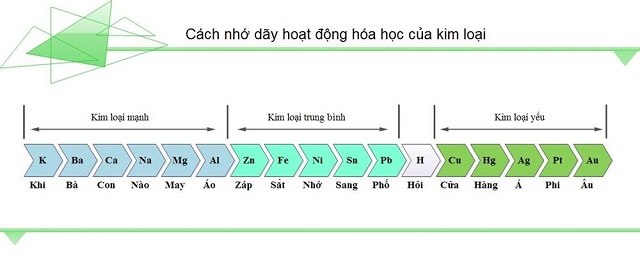
Khi (K) Nào (Na) Cần (Ca) Mua (Mg) Áo (Al) Záp (Zn) Sắt (Fe) Nhìn (Ni) Sang (Sn) Phải (Pb) Hỏi (H) Của (Cu) Hàng (Hg) Á (Ag) Phi (Pt) u (Au).
Giải thích:
Nhìn vào dãy hoạt động hoá học của kim loại trên ta sẽ thấy mức độ hoạt động hóa học của các kim loại giảm dần như sau:
K > Na > Ca > Mg > Al > Zn > Fe > Ni > Sn > Pb > H > Cu > Hg > Ag > Pt > Au
Trong đó:
- Các kim loại mạnh tan trong nước gồm có: K, Na, Ca
- Các kim loại trung bình, KHÔNG tan trong nước gồm có: Mg, Al, Zn, Fe, Ni, Sn, Pb
- Các kim loại yếu, không tan trong nước gồm có: Cu, Hg, Ag, Pt, Au
Dãy hoạt động hóa học của kim loại lớp 9 có ý nghĩa gì?
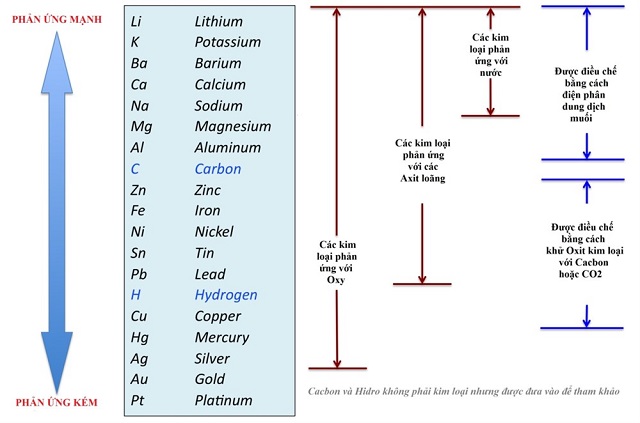
Mức độ hoạt động hóa học của các kim loại giảm dần từ trái sang phải.
Độ hoạt động hay còn gọi là khả năng phản ứng của các kim loại giảm dần từ Li tới Au.
Đặc trưng nhất là phản ứng với nước. Khi 5 kim loại đầu tiên đều tác dụng dễ dàng với nước ở điều kiện thường thì các kim loại từ Mg trở đi khó phản ứng (như Fe phải tác dụng ở nhiệt độ cao) hoặc không phản ứng như Au, Sn, Pb…v..v
Ví dụ:
- Na, K ở đầu dãy phản ứng mạnh với nước ở nhiệt độ thường còn Fe thì không.
- Fe tan trong axit HCl còn Cu, Ag không phản ứng được.
- Cu phản ứng được với O2 còn Au thì không.
Kim loại đứng trước Mg phản ứng với nước ở điều kiện thường giải phóng khí H2
Ví dụ: 2Na + 2H2O ⟶ 2NaOH + H2

Kim loại đứng trước H phản ứng với một số axit (HCl, H2SO4 loãng,…) giải phóng khí H2
Ví dụ:
- 2K + 2HCl ⟶ 2KCl + H2
- Fe + 2HCl ⟶ FeCl2 + H2
- 2Al + 3H2SO4 ⟶ Al2(SO4)3 + 3H2
Các kim loại Na, K tác dụng với dung dịch thì sẽ phản ứng đồng thời với nước và axit, nhưng có thể coi phản ứng với axit trước và nước sau để giải quyết bài tập.
Kim loại đứng trước (từ Mg trở đi) đẩy kim loại đứng sau ra khỏi dung dịch muối
Ví dụ:
- Fe + CuSO4 ⟶ FeSO4 + Cu
- Cu + 2AgNO3 ⟶ Cu(NO3)2 + 2Ag
- Mg + FeCl2 ⟶ MgCl2 + Fe
Chú ý:
- Fe có muối hóa trị II và III nên có nhiều phản ứng đặc biệt
Ví dụ:
-
-
-
- Fe + 3AgNO3 ⟶ Fe(NO3)3 + 3Ag
- Cu + 2FeCl3 ⟶ CuCl2 + 2FeCl2
- Fe + 2Fe(NO3)3 ⟶ 3Fe(NO3)2
-
-
- Cho Na, K vào dung dịch muối thì Na, K phản ứng với nước trước tạo thành kiềm và kiềm sẽ tác dụng tiếp với muối (nếu có phản ứng)
Ví dụ: Cho Na vào dung dịch muối CuSO4 thấy xuất hiện kết tủa và khí
-
-
-
- 2Na + 2H2O ⟶ 2NaOH + H2↑
- CuSO4 + 2NaOH ⟶ Cu(OH)2↓ + Na2SO4
-
-
Kim loại tác dụng với nước:
Một số kim loại hoạt động mạnh tác dụng với nước để tạo bazơ tương ứng và giải phóng chất khí là Hidro. Đây là tính chất khá quen thuộc của các kim loại đứng đầu trong dãy – những kim loại mạnh nhất.
Phương trình hóa học:
- Na+H2O→NaOH+H2↑
- Ba+2H2O→Ba(OH)2+H2↑
Kim loại tác dụng với Axit tạo ra muối và giải phóng khí hidro
Các kim loại trong dãy phản ứng với axit tạo ra muối và khí hidro phải thỏa mãn hai điều kiện:
- Kim loại đứng trước nguyên tố hidro trong dãy hoạt động hóa học
- Dung dịch axit phản ứng phải là axit loãng
Ví dụ: Fe+2HCl——>FeCl2+H2
Kim loại tác dụng với muối
Một ý nghĩa khá quan trọng nữa được suy ra từ dãy hoạt động hóa học của kim loại đó là kim loại tác dụng với muối. Phản ứng xảy ra phải thỏa mãn các điều kiện sau:
- Kim loại của đơn chất phải đứng trước kim loại của hợp chất (xét trong vị trí của dãy hoạt động hóa học)
- Kim loại của đơn chất phải bắt đầu từ Mg trở về sau (tức là: Mg, Al, Zn…)
Ví dụ: Phản ứng giữa Mangan với muối của sắt: Mg+FeCl2—->MgCl2+Fe
Trên đây là kiến thức về dãy hoạt động hóa học kim loại và các tính chất cơ bản của chúng. Hy vọng những thông tin trên sẽ giúp các em nắm vững hơn kiến thức và có thể áp dụng giải các bài toán có liên quan tới dãy hoạt động hóa học của kim loại lớp 9 này một cách tốt nhất.