Bài 1 trang 34 SGK Hóa học 10 Nâng cao
Dãy nào trong những dãy sau đây gồm những phân lớp electron đã bão hòa ?
A. \ ( { s ^ 1 }, { p ^ 3 }, { d ^ 7 }, { f ^ { 12 } } \ ) B. \ ( { s ^ 2 }, { p ^ 5 }, { d ^ 9 }, { f ^ { 13 } }. \ )
C. \({s^2},{p^4},{d^{10}},{f^{11}}.\) D. \({s^2},{p^6},{d^{10}},{f^{14}}.\)
Giải
Chọn D .
Bài 2 trang 34 SGK Hóa học 10 Nâng cao
Cấu hình electron ở trạng thái cơ bản của nguyên tử sắt kẽm kim loại nào sau đây có electron độc thân ở obitan s ?
A. Crom B. Coban
C. Sắt D. Mangan
E. Niken
Giải
Cr (Z=24): \(1s^2 2s^2 2p^6 3s^2 3p^6 4s^1 3d^5\)
Theo lý thuyết thì phải là \(4s^2 3d^4\) nhưng 1e ở \(4s^2\) đã nhảy vào \(3d^4\) để cấu hình đạt mức bán bão hòa vì vậy mà Crom có e độc thân ở phân lớp s (\(4s^1\))
Fe (Z=26) : \(1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^6\Rightarrow\) ko có
Mn (Z=25) : \(1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^5\Rightarrow\) ko có
Ni (Z=28) : \(1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^8\Rightarrow\) ko có
Bài 3 trang 34 SGK Hóa học 10 Nâng cao
Mức nguồn năng lượng của những obitan \ ( 2 { p_x }, 2 { p_y } \ ) và \ ( 2 { p_z } \ ) có khác nhau không ? Vì sao ?
Giải
Năng lượng của những obitan \ ( 2 { p_x }, 2 { p_y } \ ) và \ ( 2 { p_z } \ ) không khác nhau .
Vì phân lớp p có 3 obitan trên cùng 1 phân lớp có mức nguồn năng lượng như nhau chỉ khác nhau về sự khuynh hướng trong khoảng trống .
Bài 4 trang 34 SGK Hóa học 10 Nâng cao
Hãy cho biết số electron tối đa :
a ) Trong những lớp K, L, M, N .
b ) Trong những phân lớp s, p, d, f .
Giải
a ) Phân lớp K chứa tối đa 2 electron ; phân lớp L chứa tối đa 8 electron, phân lớp M chứa tối đa 18 electron ; phân lớp N chứa tối đa 32 electron .
b ) Phân lớp s chứa tối đa 2 electron ; phân lớp p chứa tối đa 6 electron, phân lớp d chứa tối đa 10 electron ; phân lớp f chứa tối đa 14 electron .
Bài 5 trang 34 SGK Hóa học 10 Nâng cao
Sự phân bổ những electron vào mỗi obitan nguyên tử ở trạng thái cơ bản sau có được viết đúng không ? Hãy lý giải ?
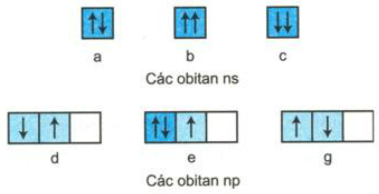
Giải
Ta có :
a) Viết đúng quy ước.
b ) Không viết đúng quy ước
c ) Không viết đúng quy ước
d ) Không viết đúng quy ước
e ) Viết đúng qui ước .
f ) Không viết đúng qui ước .
Giải thích : Sự xắp xếp những electron vào những obitan theo dựa theo quy tắc Hun, nguyên tắc Pau-li, nguyên lí bền vững và kiên cố .
Bài 6 trang 34 SGK Hóa học 10 Nâng cao
Khi số hiệu nguyên tử Z tăng, trật tự những mức nguồn năng lượng AO tăng dần theo chiều từ trái qua phải có đúng trật tự như dãy sau không ?
1 s 2 s 2 p 3 s 3 p 3 d 4 s 4 p 4 d 4 f 5 s 5 p 6 s 5 d 6 p 7 s 5 f 6 d …
Giải
Khi số hiệu nguyên tử Z tăng, trật tự nguồn năng lượng AO tăng dần theo chiều từ trái qua phải và trật tự từ thấp lên cao theo dãy :
1 s 2 s 2 p 3 s 3 p 3 d 4 s 4 p 4 d 4 f 5 s 5 p 6 s 5 d 6 p 7 s 5 f 6 d … là sai
Sửa lại là : 1 s 2 s 2 p 3 s 3 p 4 s 3 d 4 p 5 s 4 d 5 p 6 s 4 f 5 d 6 p 7 s 5 f 6 d …
Bài 7 trang 34 SGK Hóa học 10 Nâng cao
Viết thông số kỹ thuật electron nguyên tử của những nguyên tố có Z = 15 Z = 17, Z = 20, Z = 21, Z = 31 .
Giải
Cấu hình e nguyên tử của những nguyên tố có :
Z = 15 : \ ( 1 s ^ 2 2 s ^ 2 2 p ^ 6 3 s ^ 2 3 p ^ 3 \ )
Z = 17 : \ ( 1 s ^ 2 2 s ^ 2 2 p ^ 6 3 s ^ 2 3 p ^ 5 \ )
Z = 20 : \ ( 1 s ^ 2 2 s ^ 2 2 p ^ 6 3 s ^ 2 3 p ^ 6 4 s ^ 2 \ )
Z = 21 : \ ( 1 s ^ 2 2 s ^ 2 2 p ^ 6 3 s ^ 2 3 p ^ 6 3 d ^ 1 4 s ^ 2 \ )
Z = 31 : \ ( 1 s ^ 2 2 s ^ 2 2 p ^ 6 3 s ^ 2 3 p ^ 6 3 d ^ { 10 } 4 s ^ 2 4 p ^ 1 \ )
Bài 8 trang 34 SGK Hóa học 10 Nâng cao
Nguyên tử Fe có Z = 26. Hãy viết thông số kỹ thuật electron của Fe
Nếu nguyên tử Fe bị mất hai electron, mất ba electron thì những thông số kỹ thuật electron tương ứng sẽ như thế nào ?
Giải
Fe ( Z = 26 ) : \ ( 1 s ^ 2 2 s ^ 2 2 p ^ 6 3 s ^ 2 3 p ^ 6 3 d ^ 6 4 s ^ 2 \ )
\ ( Fe ^ { 2 + } \ ) ( Z = 26 ) : \ ( 1 s ^ 2 2 s ^ 2 2 p ^ 6 3 s ^ 2 3 p ^ 6 3 d ^ 6 \ )
\(Fe^{3+}\) (Z = 26): \(1s^2 2s^2 2p^6 3s^2 3p^6 3d^5\)
Xem thêm: Sự khác biệt giữa vi khuẩn và virut
Giaibaitap.me
Source: https://futurelink.edu.vn
Category: Tin tổng hợp