Lý thú nhưng đầy thách thức – Hóa học là một môn mà để đạt điểm cao trong kỳ thi THPT Quốc Gia đòi hỏi học sinh cần ghi nhớ lý thuyết hóa 12 một cách chắc chắn, đồng thời nắm vững các dạng bài tập theo từng chuyên đề. Tổng hợp lý thuyết hóa học 12 vô cơ và hữu cơ một cách chi tiết và đầy đủ sẽ là chìa khóa giúp bạn công phá môn học này. Hãy cùng DINHNGHIA.VN tóm tắt lý thuyết hóa 12 qua nội dung bài viết dưới đây!.
Tổng hợp lý thuyết hóa học 12 ôn thi đại học
Trong kỳ thi trung học phổ thông Quốc gia, kỹ năng và kiến thức hầu hết là hóa học 12. Tuy nhiên, học viên cũng cần ôn tập rất đầy đủ phần kiến thức hóa lớp 10 và 11. Với trọng tâm ôn thi, dưới đây là những nội dung tổng hợp lý thuyết hóa 12 mà học viên cần chú ý quan tâm khi ôn tập .
Kiến thức về lý thuyết Este
Khái niệm về Este
- Nếu ta thay nhóm OH ở nhóm cacboxyl của axit cacboxylic bằng nhóm OR ’ thì ta sẽ được este .
- hidrocacbon hay H; R’ là gốc hidrocacbon. Với este đơn chức RCOOR ’, thì trong đó R là gốchay H ; R ’ là gốc hidrocacbon .
- Ta sẽ có Este no đơn chức mạch hở : \ ( C_ { n } H_ { 2 n } O_ { 2 } \ ) ( với \ ( n \ geq 2 \ ) )
Danh pháp của Este
Tên gốc R ’ ( gốc ankyl ) + tên gốc axit RCOO ( đuôi at )
Ví dụ: \(CH_{3}COOC_{2}H_{5}\): Etyl axetat
\ ( CH_ { 2 } = CH-COOCH_ { 3 } \ ) : Metyl acrylat
\ ( CH_ { 3 } COOCH_ { 2 } C_ { 6 } H_ { 5 } \ ) : benzylaxetat
Tính chất vật lý của Este
- Este được biết đến là có nhiệt độ sôi, độ tan trong nước thấp hơn axit và ancol có cùng số cacbon : axit > ancol > este .
- Mùi đặc trưng của Este : Isoamyl axetat sẽ có mùi chuối chín hay Etyl butiat, etyl propionat lại có mùi dứa .
Tính chất hóa học của Este
- Este khi thủy phân trong môi trường tự nhiên axit tạo ra 2 lớp chất lỏng và là phản ứng thuận nghịch ( 2 chiều ) .
\ ( RCOOR ’ + H_ { 2 } O \ rightarrow RCOOH + R’OH \ )
2. Ngược lại, Este khi thủy phân trong môi trường tự nhiên kiềm ( Phản ứng xà phòng hóa ) lại à phản ứng 1 chiều
\ ( RCOOR ’ + NaOH \ rightarrow RCOONa + R’OH \ )
3. Este đốt cháy tạo thành \ ( CO_ { 2 } \ ) và \ ( H_ { 2 } O \ ) nếu este là este no đơn chức và mạch hở ( \ ( C_ { n } H_ { 2 n } O_ { 2 } \ ) )
4. Este Open phản ứng tráng bạc .
Cách điều chế Este
- \ ( Axit + Ancol \ rightleftharpoons Este + H_ { 2 } O \ )
- \ ( RCOOH + R’OH \ rightleftharpoons RCOOR ’ + H_ { 2 } O \ )
Xem cụ thể :
Kiến thức về lý thuyết Lipit
Khái niệm về Lipit
- Lipit được biết đến chính là những hợp chất hữu cơ có trong tế bào sống. Lipit vốn không hòa tan trong nước nhưng lại tan nhiều trong dung môi hữu cơ không phân cực .
- Chất béo là trieste của glixerol cùng với axit béo được gọi chung là triglixerit hay triaxylglixerol .
Công thức chung Lipit

\ ( R_ { 1 }, R_ { 2 }, R_ { 3 } \ ) : là gốc hidrocacbon giống hoặc khác nhau
Ví dụ :
\ ( ( C_ { 17 } H_ { 35 } COO ) _ { 3 } C_ { 3 } H_ { 5 } \ ) : tristearoylglixerol ( tristearin ) : chất béo no ( chất rắn )
Tính chất vật lí của Lipit
- Ở nhiệt độ thường, chất béo ở trạng thái lỏng khi trong phân tử có gốc hidrocacbon không no. Ở trạng thái rắn khi trong phân tử có gốc hidrocacbon no .
- Chất béo không tan trong nước, nhẹ hơn nước .
Tính chất hóa học của Lipit
- Phản ứng thủy phân của Lipit
\ ( ( C_ { 17 } H_ { 35 } COO ) _ { 3 } C_ { 3 } H_ { 5 } + 3H _ { 2 } O \ rightarrow C_ { 17 } H_ { 35 } COOH + C_ { 3 } H_ { 5 } ( OH ) _ { 3 } \ )
2. Phản ứng xà phòng hóa của Lipit : muối của axit béo ( xà phòng ) và glixerol
\ ( ( C_ { 17 } H_ { 35 } COO ) _ { 3 } C_ { 3 } H_ { 5 } + 3N aOH \ rightarrow 3C _ { 17 } H_ { 35 } COONa + C_ { 3 } H_ { 5 } ( OH ) _ { 3 } \ )
3. Phản ứng cộng hidro của chất béo lỏng thành chất béo rắn ( bơ tự tạo )
\ ( ( C_ { 17 } H_ { 33 } COO ) _ { 3 } C_ { 3 } H_ { 5 } + 3H _ { 2 } \ rightarrow ( C_ { 17 } H_ { 35 } COO ) _ { 3 } C_ { 3 } H_ { 5 } \ )
Xem thêm >>> Phản ứng xà phòng hóa: Lý thuyết và Bài tập ứng dụng
Ôn tập lý thuyết hóa 12: Cacbohiđrat
- Cacbohiđrat được biết đến là những hợp chất hữu cơ tạp chức và thường có CTCT hóa học như sau : \ ( C_ { n } ( H_ { 2 } O ) _ { m } \ )
- Cacbohidrat thường được chia làm 3 loại hầu hết dưới đây :
- Monosaccaritlà nhóm không bị thủy phân (glucozơvàfructozơ) .
- Đisaccaritchính là nhóm mà khi thủy phân mỗi phân tử sẽ sinh ra 2 phân tử monosaccarit .
- Polisaccarit là nhóm mà khi ta thủy phân đến cùng mỗi phân tử thì sẽ sinh ra nhiều phân tử monosaccarit .
Kiến thức về lý thuyết Glucozơ
Tính chất vật lý của Glucozơ
Trong máu người sẽ có nồng độ glucozơ không đổi khoảng chừng 0,1 %
Cấu tạo phân tử của Glucozơ
- Glucozơ có CTPT hóa học : \ ( C_ { 6 } H_ { 12 } O_ { 6 } \ )
- Glucozơ có CTCT : \ ( CH_ { 2 } OH-CHOH-CHOH-CHOH-CHOH-CH = O \ ) hoặc \ ( CH_ { 2 } OH [ CHOH ] _ { 4 } CHO \ )
- Trên trong thực tiễn thì Glucozơ sống sót hầu hết ở dạng mạch vòng : chính là dạng a-glucozơ và b – glucozơ .
Tính chất hóa học của Glucozơ
- Tính chất củaancolđa chức :
- Tác dụng với \ ( Cu ( OH ) _ { 2 } \ ) : ở nhiệt độ sẽ thường tạo phức đồng glucozơ ( dung dịch màu xanh lam phân biệt glucozơ ) .
- Phản ứng tạo este : tạo este chứa 5 gốc axit .
2. Tính chất của andehit :
- Oxi hóa glucozơ bằng dung dịch \ ( AgNO_ { 3 } \ ) ta có :
\ ( C_ { 6 } H_ { 12 } O_ { 6 } + 2A gNO_ { 3 } + 2NH _ { 3 } + H_ { 2 } O \ rightarrow HOCH_ { 2 } [ CHOH ] _ { 4 } COONH_ { 4 } + 2A g + 2NH _ { 4 } NO_ { 3 } \ )
- Khử glucozơ bằng H2 để tạo thành sobitol
\ ( C_ { 6 } H_ { 12 } O_ { 6 } + H_ { 2 } \ rightarrow C_ { 6 } H_ { 14 } O_ { 6 } \ )
3. Phản ứng lên men như sau :
\ ( C_ { 6 } H_ { 12 } O_ { 6 } \ rightarrow 2C _ { 2 } H_ { 5 } OH + 2CO _ { 2 } \ )
Kiến thức về lý thuyết Fructozơ
Công thức cấu trúc của Fructozơ :
- \ ( C_ { 6 } H_ { 12 } O_ { 6 } \ ) : đồng phân của glucozơ
- CTCT mạch hở Fructozơ như sau : \ ( CH_ { 2 } OH-CHOH-CHOH-CHOH-CO-CH_ { 2 } OH \ )
- Tính chất ancol đa chức ( phản ứng \ ( Cu ( OH ) _ { 2 } \ ) ở nhiệt độ thường tạo dd xanh lam nhận ra ) .
- Fructozơ \ ( \ rightleftharpoons \ ) Glucozơ
- Trong môi trường tự nhiên bazơ fructozơ chuyển thành glucozơ \ ( \ rightarrow \ ) fructozơ bị oxi hóa bởi \ ( AgNO_ { 3 } / NH_ { 3 } \ ) và \ ( Cu ( OH ) _ { 2 } \ ) trong môi trường tự nhiên kiềm tựa như glucozơ .
Kiến thức về Saccarozơ (đường mía)
- Saccarozơchính là một gốc glucozơ cùng với một gốc fructozơ link qua O .
- Saccarozơ tham gia phản ứng thủy phân ( có axit \ ( H ^ { + } \ ) xúc tác ) và tính năng \ ( Cu ( OH ) _ { 2 } \ ) ( tạo dung dịch màu xanh lam )
\ ( 2C _ { 12 } H_ { 22 } O_ { 11 } + Cu ( OH ) _ { 2 } \ rightarrow ( C_ { 12 } H_ { 21 } O_ { 11 } ) _ { 2 } Cu + 2H _ { 2 } O \ )
Kiến thức về Mantozơ (đường mạch nha)
- Mantozơ thực tiễn sẽ gồm có 2 gốc glucozơ để tạo thành .
- Mantozơ tham gia phản ứng thủy phân ( có axit \ ( H ^ { + } \ ) xúc tác )
\ ( C_ { 12 } H_ { 22 } O_ { 11 } + H_ { 2 } O \ rightarrow 2C _ { 6 } H_ { 12 } O_ { 6 } \ )
- Tính chất của mantozơ cũng tương tự như như với glucozơ .
Kiến thức về lý thuyết Tinh bột
- Tinh bột chính là hỗn hợp của amilozo và amilopectin .
- Tinh bột do alpha glucozo tạo thành
- Tinh bột tham gia phản ứng thủy phân ( có axit \ ( H ^ { + } \ ) xúc tác )
\ ( ( C_ { 6 } H_ { 10 } O_ { 5 } ) _ { n } + n_ { H_ { 2 } O } \ rightarrow nC_ { 6 } H_ { 12 } O_ { 6 } \ )
Kiến thức về lý thuyết Xenlulozơ
- Xenlulozo do beta glucozo tạo thành và có 3 nhóm OH – tự do
- Xenlulozo tham gia phản ứng thủy phân ( có axit \ ( H ^ { + } \ ) xúc tác )
\ ( ( C_ { 6 } H_ { 10 } O_ { 5 } ) _ { n } + n_ { H_ { 2 } O } \ rightarrow nC_ { 6 } H_ { 12 } O_ { 6 } \ )
Tổng hợp lý thuyết hóa 12 chương 3: Amin, Amino Axit, Protein


Tóm tắt lý thuyết hóa 12 chương 4: Polime và vật liệu polime
Khái niệm về Polime
Polyme được biết đến là những hợp chất có phân tử khối rất lớn do nhiều đơn vị cơ sở (gọi là mắt xích) liên kết với nhau để tạo nên.
Cách phân loại Polime
- Theo nguồn gốc
- Polime tổng hợp .
- Polime vạn vật thiên nhiên .
- Polime bán tổng hợp .
2. Theo cách tổng hợp
- Polime trùng hợp .
- Polime trùng ngưng .
3. Theo đặc thù cấu trúc
- Polime mạch không phân nhánh .
- Polime mạch phân nhánh .
- Polime mạng khoảng trống .
Tính chất vật lý của Polime
- Hầu hết là chất rắn, không bay hơi, không có nhiệt độ nóng chảy xác lập
- Không tan trong những dung môi thường thì
- Một số có tính dẻo, 1 số ít có tính đàn hồi, một số ít hoàn toàn có thể kéo sợi
Phương pháp điều chế Polime
- Phản ứng trùng hợp
- Quá trình cộng hợp liên tục nhiều phân tử nhỏ ( monome ) giống nhau hay tương tự như nhau thành phân tử lớn ( polime ) .
- Điều kiện :Monomecó link bội hoặc vòng kém bền .
2. Phản ứng trùng ngưng :
- Phản ứng trùng ngưngđược biết đến chính là quy trình phối hợp nhiều phân tử nhỏ ( monome ) thành phân tử lớn ( polime ) đồng thời giải phóng những phân tử nhỏ khác .
- Điều kiện cần : Monome có tối thiểu 2 nhóm chức có năng lực phản ứng .
Một số phản ứng điều chế thường gặp
- Nhựa PE
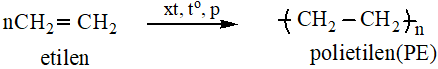
2. Nhựa PVC

3. Nhựa PS

4. Cao su buna
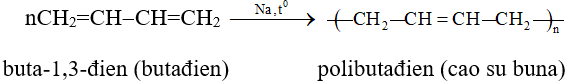
5. Cao su buna-S
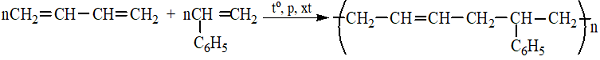
6. Cao su buna-N
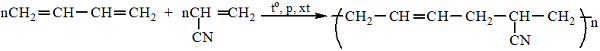
7. Tơ nilon-6

8. Tơ nilon-7
![]()
9. Tơ nilon-6, 6
![]()
Tổng hợp kiến thức hóa học 12: Đại cương về kim loại
Trong chương trình hóa học 12, để nắm vững lý thuyết hóa 12 chuyên đề Đại cương về sắt kẽm kim loại, bạn cần nắm vững những kỹ năng và kiến thức dưới đây :
- Kim loại cũng nhưdãy điện hóa của kim loại.
- Hợp kim cũng nhưsự ăn mòn kim loại.
- Cách điều chế sắt kẽm kim loại .
Vị trí kim loại trong bảng tuần hoàn và cấu tạo của kim loại
Vị trí của kim loại trong bảng tuần hoàn
- Nhóm IA ( trừ H ), IIA, IIIA ( trừ B ), một phần nhóm IVA, VA, VIA .
- Cáckim loại nhóm B( từ nhóm IB đến VIIIB ) .
- Họ lantan và actini ( 2 hàng cuối trong BTH ) .
Đặc điểm và cấu tạo của kim loại
- Cấu tạo nguyên tử:Ít e lớp ngoài cùng ( 1 đến 3 e ), nửa đường kính nguyên tử tương đối lớn so với phi kim
- Cấu tạo tinh thể:Trong mạng tinh thể Kim loại có nguyên tử sắt kẽm kim loại, Ion sắt kẽm kim loại ở nút mạng và những electron tự do .
- Liên kết kim loại:Liên kết được hình thành giữa những nguyên tử sắt kẽm kim loại và ion sắt kẽm kim loại do sự tham gia của những electron tự do .
Chú ý: Mối quan hệ giữa cấu hình e và vị trí trong bảng tuần hoàn.
- Số hiệu ( Z = số e = số p ) \ ( \ leftrightarrow \ ) Ô ( số thứ tự ) .
- Số lớp \ ( \ leftrightarrow \ ) Chu kỳ .
- Số e lớp ngoài cùng \ ( \ leftrightarrow \ ) Số thứ tự nhóm ( nhóm A ) so với nguyên tố s, p \ ( \ leftrightarrow \ ) Hóa trị cao nhất với oxi .
Tính chất của kim loại – Dãy điện hóa của kim loại
Tính chất vật lý của kim loại
- Tính chất vật lí chung của sắt kẽm kim loại : 4 đặc thù = dẻo + dẫn điện + dẫn nhiệt + ánh kim .
-
Nguyên nhân: Do e tự do gây ra.
Tính chất hóa học của kim loại
Với tính chất hóa học của kim loại, ta thấy như sau:
- Tính khử = Nhường e = Bị oxi hóa
- Nguyên nhân : Ít e lớp ngoài cùng + Bán kính lớn + Lực link hạt nhân yếu .
- Tác dụng với phi kim .
- Tác dụng với axit .
- Tác dụng với \ ( HCl, H_ { 2 } SO_ { 4 } \ ) loãng ( sắt kẽm kim loại trước \ ( H_ { 2 } \ ) ) \ ( \ rightarrow \ ) Muối ( Số OXH thấp ) + \ ( H_ { 2 } \ )
- Tác dụng với dung dịch \ ( HNO_ { 3 }, H_ { 2 } SO_ { 4 } \ ) đặc ( tổng thể kim loai trừ Au, Pt ) \ ( \ rightarrow \ ) Muối ( Số OXH cao ) + Sp khử + nước
Chú ý: Al, Fe, Cr không phản ứng với \(HNO_{3}, H_{2}SO_{4}\) đặc nguội.
3. Tác dụng với nước : Kim loại IA + IIA ( trừ Be, Mg ) + \ ( H_ { 2 } O \ )
4. \ ( \ rightarrow \ ) dd bazơ + \ ( H_ { 2 } \ )
\ ( M \, ( IA ) + H_ { 2 } O \ rightarrow MOH + H_ { 2 } \ )
\ ( M \, ( Ca, Ba, Sr ) + 2H _ { 2 } O \ rightarrow M ( OH ) _ { 2 } + H_ { 2 } \ )
5. Tác dụng với dd muối
- Kim loại ( không tan trong nước ) đẩy được sắt kẽm kim loại yếu hơn ra khỏi muối .
- Kim loại ( tan trong nước ) thì không đẩy được sắt kẽm kim loại yếu ra khỏi muối mà xảy ra theo nhiều quá trình :
- Phản ứng với nước \ ( \ rightarrow \ ) dd bazơ
- Dung dịch bazơ phản ứng trao đổi với dd muối ( nếu sau phản ứng có kết tủa )
- Nếu kết tủa có tính lưỡng tính thì liên tục tan .
6. Tác dụng với dung dịch bazơ : Al, Zn tan được trong dung dịch bazơ .
\ ( Al + NaOH + H_ { 2 } O \ rightarrow NaAlO_ { 2 } + 1,5 H_ { 2 } \ )
Tìm hiểu dãy điện hóa của kim loại
- Nguyên tắc sắp xếp : Từ trái sang phải trong dãy điện hóa của sắt kẽm kim loại như sau :
- Tính khử sắt kẽm kim loại giảm dần .
- Tính oxi hóa ion sắt kẽm kim loại cũng tăng dần .
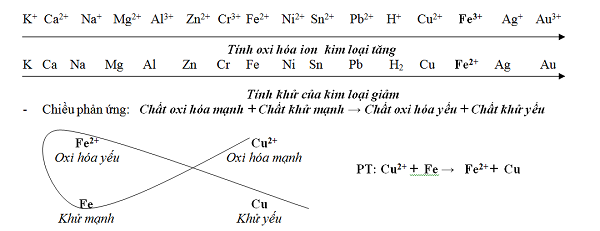
Ý nghĩa của dãy điện hóa kim loại: Giúp dự đoán chiều của phản ứng giữa 2 cặp oxi hóa – khử theo quy tắc alpha.
Sự ăn mòn kim loại
- Sự ăn mòn kim loạilà sự tàn phá sắt kẽm kim loại hoặc kim loại tổng hợp do tính năng những chất trong thiên nhiên và môi trường xung quanh .
- Có 2 dạng ăn mòn sắt kẽm kim loại : Ăn mòn hóa học và ăn mòn điện hóa
- Ăn mòn hóa học là quy trình oxi hóa khử, e của sắt kẽm kim loại chuyển trực tiếp đến những chất trong môi trường tự nhiên
- Ăn mòn điện hóalà quy trình oxi hóa khử, do tính năng chất điện li tạo dòng e vận động và di chuyển từ cực âm đến cực dương .
Điều kiện ăn mòn kim loại
- Có 2 điện cực khác chất ( 2 KL khác nhau, KL-PK, KL – hợp chất … ) .
- Khi 2 điện cực tiếp xúc với nhau ( trực tiếp hoặc gián tiếp ) .
- Được đặt trong môi trường tự nhiên chất điện li ( dung dịch ; không khí ẩm cũng là thiên nhiên và môi trường điện li ) .
Cơ chế ăn mòn kim loại
- Ta có : Cực âm ( anot ) = sắt kẽm kim loại mạnh = quy trình oxi hóa = sắt kẽm kim loại bị ăn mòn .
\ ( M \ rightarrow M ^ { n + } + ne \ )
- Cực dương ( catot ) = sắt kẽm kim loại yếu ( hoặc PK ) = quy trình khử .
\ ( 2H ^ { + } + 2 e \ rightarrow H_ { 2 } \ )
\ ( O_ { 2 } + 2H _ { 2 } O + 4 e \ rightarrow 4OH ^ { – } \ )
Tóm lại: Nếu ăn mòn điện hóa thì kim loại mạnh sẽ bị ăn mòn trước.
Có 2 cách chống ăn mòn :
- Bảo vệ bề mặt:bôi, sơn, mạ, tráng … bằng vật tư bền với môi trường tự nhiên
- Phương pháp điện hóa:Dùng sắt kẽm kim loại hoạt động giải trí hơn để bảo vệ ( sắt kẽm kim loại hoạt động giải trí hơn sẽ bị ăn mòn trước )
Ví dụ: Vỏ tàu biển bằng thép được gắn vào các khối kẽm (khi đó Zn bị ăn mòn điện hóa).
Phương pháp điều chế kim loại
Trong phương pháp điều chế kim loại, bạn cần lưu ý như sau:
Nguyên tắc điều chế kim loại
Khử ion sắt kẽm kim loại thành sắt kẽm kim loại : \ ( M ^ { n + } + ne \ rightarrow M \ ) ( sắt kẽm kim loại )
Phương pháp đơn cử như sau :
- Nhiệt luyện :
- Dùng chất khử mạnh ( C, CO, \ ( H_ { 2 } \ ), Al ) để khử sắt kẽm kim loại trong oxit ( Từ Zn \ ( \ rightarrow \ ) Cu )
- Ứng dụng : Điều chế sắt kẽm kim loại hoạt động giải trí trung bình ( Từ Zn \ ( \ rightarrow \ ) Cu )
Ví dụ : \(4CO + Fe_{3}O_{4} \rightarrow 3Fe + 4CO_{2}\)
- Thủy luyện :
- Nguyên tắc : Dùng sắt kẽm kim loại có tính khử mạnh khử ion của sắt kẽm kim loại yếu hơn ra khỏi muối
- Ứng dụng : Điều chế sắt kẽm kim loại hoạt động giải trí trung bình và yếu
2. Điện phân :
- Khử ion sắt kẽm kim loại bằng dòng điện một chiều
- Catot ( cực âm ) : xảy ra quy trình khử = khử cation thu được sắt kẽm kim loại
- Anot ( cực dương ) : xảy ra quy trình oxi hóa thu được chất khí
- Điện phân nóng chảy : Điều chế sắt kẽm kim loại mạnh ( IA, IIA, Al ) .
- Điện phân dung dịch : Điều chế sắt kẽm kim loại hoạt động giải trí trung bình hoặc yếu
Sơ đồ điện phân dung dịch

Tìm hiểu định luật Faraday
Định luật Faraday giúp tính khối lượng các chất thoát ra ở các điện cực: m = A.I.t / 96500.n
Trong đó :
- m:Khối lượng chất thoát ra ở điện cực
- A:Khối lượng mol nguyên tử
- n: Số e cho hoặc nhận
- I:Cường độ dòng điện ( Ampe )
- t:Thời gian điện phân ( Giây )
Nhận biết một số chất khí trong dung dịch
Với kỹ năng và kiến thức lý thuyết hóa 12, bạn cần chú ý quan tâm về cách nhận biết 1 số ít chất khí như sau :
Khí CO
- Thuốc thử : Dung dịch \ ( PdCl_ { 2 } \ )
- Hiện tượng : dung dịch bị sẫm màu, có khí thoát ra .
- Phương trình phản ứng :\(CO + H_{2}O + PdCl_{2} \rightarrow 2HCl + CO_{2} + Pd\)
Khí \(CO_{2}\)
- Thuốc thử : Sử dụng dịch nước vôi trong
- Hiện tượng xảy ra là làm đục nước vôi trong sau đó dung dịch trở nên trong suốt .
- Phương trình phản ứng :
- \ ( CO_ { 2 } + Ca ( OH ) _ { 2 } \ rightarrow CaCO_ { 3 } + H_ { 2 } O \ )
- \ ( CaCO_ { 3 } + H_ { 2 } O + CO_ { 2 } \ rightarrow Ca ( HCO_ { 3 } ) _ { 2 } \ )
Khí \(SO_{2}\)
- Khí \ ( SO_ { 2 } \ ) thường có mùi hắc khó ngửi, khó ngưởi và làm phai màu hoa hồng .
- Thuốc thử : Sử dụng dung dịch brom hoặc dung dịch thuốc tím .
- Hiện tượng : Làm mất màu dung dịch nước Brom hoặc làm mất màu dung dịch thuốc tím .
- Phương trình phản ứng :
- \ ( Br_ { 2 } + 2H _ { 2 } O + SO_ { 2 } \ rightarrow H_ { 2 } SO_ { 4 } + 2HB r \ )
- \ ( 5SO _ { 2 } + 2KM nO_ { 4 } + 2H _ { 2 } O \ rightarrow 2H _ { 2 } SO_ { 4 } + 2M nSO_ { 4 } + K_ { 2 } SO_ { 4 } \ )
Khí \(SO_{3}\)
- Thuốc thử : Dung dịch \ ( BaCl_ { 2 } \ )
- Hiện tượng : Xuất hiện kết tủa trắng .
- Phương trình phản ứng :\(BaCl_{2} + H_{2}O + SO_{3} \rightarrow 2HCl + BaSO_{4}\)
Khí \(NH_{3}\)
- Khí \ ( NH_ { 3 } \ ) có mùi khai, làm cho quỳ tím tẩm ướt hoá xanh .
- Thuốc thử : Axit HCl đặc
- Hiện tượng : Xuất hiện khói trắng
- Phương trình phản ứng :\(HCl + NH_{3} \rightarrow NH_{4}Cl\)
Khí Clo
- Thuốc thử : Dùng dung dịch KI + Hồ tinh bột
- Hiện tượng : Dung dịch từ màu trắng chuyển thành màu xanh .
- Phương trình phản ứng :\(Cl_{2} + KI\rightarrow 2KCl + I_{2}\)
Khí \(H_{2}S\)
- Khí \ ( H_ { 2 } S \ ) có mùi trứng thối .
- Thuốc thử : Dùng dung dịch \ ( Pb ( NO_ { 3 } ) _ { 2 } \ )
- Hiện tượng : Sản phẩm tạo thành là PbS kết tủa màu đen .
- Phương trình phản ứng :\(Pb(NO_{3})_{2} + H_{2}S \rightarrow PbS + 2HNO_{3}\)
Khí HCl
- Khí HCl làm giấy quỳ tẩm ướt hoá đỏ .
- Thuốc thử : Dung dịch \ ( AgNO_ { 3 } \ )
- Hiện tượng : Sản phẩm tạo thành kết tủa màu trắng của AgCl .
- Phương trình phản ứng :\(AgNO_{3} + HCl \rightarrow AgCl + HNO_{3}\)
Khí NO (không màu)
- Thuốc thử : Không khí
- Hiện tượng : hoá màu nâu đỏ
- Phương trình phản ứng :\(2NO + O_{2} \rightarrow 2NO_{2}\)
Khí \(NO_{2}\)
- Thuốc thử : Quỳ tím ẩm
- Hiện tượng : Làm quỳ tím hóa đỏ
- Hoặc làm lạnh màu nâu đỏ nhạt dần sau đó mất màu, khi hết làm lạnh lại Open màu nâu đỏ .
- Phương trình phản ứng :\(2NO_{2} \rightarrow N_{2}O_{4}\)
Khí \(O_{3}\) (ozon)
- Thuốc thử : Dung dịch KI và hồ tinh bột
- Hiện tượng : tạo thành dung dịch màu tím xanh
- Phương trình phản ứng :\(O_{3} + 2KI + H_{2}O \rightarrow KOH + I_{2} + O_{2}\)
Khí \(O_{2}\)
- Thuốc thử : Than đỏ
- Hiện tượng : Than phát cháy .
- Phương trình phản ứng :\(C + O_{2} \rightarrow CO_{2}\)
Khí \(N_{2}\)
- Thuốc thử : Que diêm đỏ
- Hiện tượng : Khí \ ( N_ { 2 } \ ) làm que diêm tắt .
Tóm tắt lý thuyết hóa 12: Hóa học và vấn đề phát triển kinh tế
Một số chất gây nghiện cần lưu ý
Rượu, thuốc phiện, cần sa, nicotin, cafein, cocain, heroin, mocphin, …
Các khí gây ô nhiễm môi trường
\ ( CO, CO_ { 2 }, SO_ { 2 }, H_ { 2 } S, CFC, \ ), bụi
Tác hại của các chất khí gây ô nhiễm môi trường:
- Hiệu ứng nhà kính
- Sức khỏe
- Sinh trưởng, tăng trưởng động, thực vật
- Phá tầng ozon, mưa axit ( do \ ( SO_ { 2 }, NO_ { 2 } \ ), … )
Sự ô nhiễm môi trường nước
Nguyên nhân gây ô nhiễm môi trường nước
- Tự nhiên : mưa, gió bão lụt \ ( \ rightarrow \ ) kéo chất bẩn
- Nhân tạo : hoạt động và sinh hoạt, giao thông vận tải vận tải đường bộ, thuốc trừ sâu
- Các tác nhân gây ô nhiễm : ion sắt kẽm kim loại nặng ( Hg, Pb, Cu, Mn, … ), anion NO3 -, \ ( NO_ { 3 } ^ { – }, PO_ { 4 } ^ { 3 – }, SO_ { 4 } ^ { 2 – }, … \ )
Tác hại của sự ô nhiễm môi trường nước
- Sự ô nhiễm thiên nhiên và môi trường nước đã làm ảnh hưởng tác động lớn sự sinh trưởng, tăng trưởng động thực vật .
- Bên cạnh đó, ô nhiễm thiên nhiên và môi trường nước cũng làm ảnh hưởng tác động trực tiếp tới sức khỏe thể chất của con người .
DINHNGHIA.VN đã cùng bạn tìm hiểu chi tiết về các kiến thức tổng hợp lý thuyết hóa 12. Hy vọng đã cung cấp cho bạn bài viết hữu ích phục vụ cho quá trình tìm hiểu cũng như ôn thi THPT Quốc Gia. Nếu có bất cứ câu hỏi hay thắc mắc gì liên quan đến chủ đề tóm tắt lý thuyết hóa 12, đừng quên để lại trong nhận xét bên dưới nha. Chúc bạn luôn học tập và ôn thi thật tốt!.
Xem thêm qua bài giảng dưới đây :
(Nguồn: www.youtube.com)
ly-thuyet-hoa-12-ban-pdf
Xem thêm :
Rate this post
Please follow and like us :
![]()
![]()
Source: https://futurelink.edu.vn
Category: Tin tổng hợp