Điện hóa học nghiên cứu và điều tra sự quy đổi lẫn nhau của những dạng nguồn năng lượng hóa học và điện. Phản ứng điện hóa có tầm quan trọng thực tiễn lớn. Ví dụ : pin điện hóa, điện phân được sử dụng trong những ngành công nghiệp, mạ điện được sử dụng để bảo vệ những mẫu sản phẩm thép khỏi bị ăn mòn, cho mục tiêu trang trí. Các quy trình điện hóa là cơ sở của nhiều chiêu thức nghiên cứu và phân tích văn minh .
Vậy sự độc lạ giữa phản ứng hóa học và điện hóa là gì ? Chúng ta hãy xem xét phản ứng hóa học sau đây :
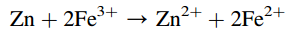
Nếu phản ứng này là một quá trình hóa học, nó sẽ được đặc trưng bởi một số đặc thù. Phản ứng hóa học chỉ có thể xảy ra trong trường hợp các chất phản ứng tiếp xúc với nhau. Do đó, yêu cầu tiếp xúc giữa các phần tử của các chất phản ứng là đặc điểm đầu tiên của sự biến đổi hóa học. Việc chuyển electron từ hạt này sang hạt kia hoặc từ chất khử (Zn) sang chất oxy hóa (Fe2+) chỉ có thể xảy ra tại thời điểm va chạm. Quãng đường dịch chuyển của các hạt electron sẽ rất ngắn và đây là đặc điểm thứ hai của quá trình hóa học. Va chạm giữa các phần tử có thể xảy ra tại bất kỳ điểm nào trong vùng tiếp xúc của các chất phản ứng, do đó quá trình chuyển đổi điện tử có thể được thực hiện theo bất kỳ hướng nào trong không gian. Tính ngẫu nhiên của các va chạm hạt và chuyển electron là đặc điểm thứ ba của phản ứng hóa học. Do những đặc trưng này, phản ứng hóa học có thể tỏa nhiệt hoặc hấp thụ nhiệt. Cần thiết lập các điều kiện nhất định trong hệ thống để chuyển đổi năng lượng từ các phản ứng hóa học thành năng lượng điện, tức là, tạo ra một quy trình điện hóa
Trong những quy trình điện hóa, việc sự di dời electron từ chất phản ứng này sang chất phản ứng khác được thực thi trên một quãng đường khá dài. Điều này được lý giải là do có sự đi qua của dòng điện, đó là một dòng những electron được cung ứng nguồn năng lượng và vận động và di chuyển dọc theo cùng một đường dẫn. Do đó, trong quy trình điện hóa khoảng trống của những chất phản ứng ( chất khử và chất oxy hóa ) cần phải phân tách để giữ cho dòng electron di dời từ chất khử sang chất oxy hóa. Trong yếu tố này, tiếp xúc trực tiếp giữa những chất phản ứng nên được thay thế sửa chữa bằng hai tấm sắt kẽm kim loại được nối với nhau bằng một dây dẫn sắt kẽm kim loại. Để bảo vệ dòng điện liên tục đi qua khoảng trống phản ứng, những hạt mang điện có độ dẫn ion cao phải xuất hiện hoặc được liên tục thêm vào dung dịch phản ứng. Do đó, một mạng lưới hệ thống điện hóa là mạng lưới hệ thống mà bên trong nó xảy ra quy trình điện hóa .
Xử lý nước thải bằng chiêu thức điện hóa có thực chất cơ bản dựa trên quy trình điện phân. Để triển khai quy trình điện phân, cần phải có một nguồn nguồn năng lượng điện bên ngoài để tạo ra và duy trì một điện thế thích hợp và hiệu quả là những phản ứng điện hóa xảy ra ở cực dương và cực âm, được đặt trong những tế bào điện hóa ( ví dụ, vào máy điện phân công nghiệp ). Michael Faraday là nhà khoa học tiên phong nghiên cứu và điều tra mối quan hệ giữa lượng điện tích Q. ( dòng điện I nhân với thời hạn t ) truyền qua mặt phẳng điện cực vào dung dịch điện phân và những phản ứng hóa học gây ra bởi điện tích này. Năm 1832 Faraday báo cáo giải trình rằng lượng điện thiết yếu để sản xuất một lượng chất nhất định không phụ thuộc vào vào size điện cực, số lượng điện cực thao tác và khoảng cách giữa những điện cực. Khối lượng m của chất được giải phóng ở điện cực tỷ suất thuận với điện tích Q., được truyền qua chất điện phân và tỷ suất thuận với khối lượng tương tự ( M / z ) của nguyên tố của chất đó :
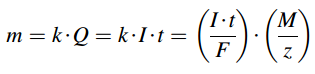 Trong đó k là đương lượng điện hóa của một chất, k = M / ( F × z ), M là khối lượng mol của một chất, 1 F = 1 mol × e – = 6.02 × 1023 × e – = e × NA = 26.8 A.h / mol = 96,485. 33289 ( 59 ) C / mol là hằng số Faraday, z là số electron tham gia phản ứng ( hóa trị của ion của chất ) .
Trong đó k là đương lượng điện hóa của một chất, k = M / ( F × z ), M là khối lượng mol của một chất, 1 F = 1 mol × e – = 6.02 × 1023 × e – = e × NA = 26.8 A.h / mol = 96,485. 33289 ( 59 ) C / mol là hằng số Faraday, z là số electron tham gia phản ứng ( hóa trị của ion của chất ) .
Michael Faraday cùng với người bạn William Whewell đã phát triển một thuật ngữ mới trong điện hóa học. Ông gọi các chất dẫn điện được ngâm trong dung dịch là điện cực (trước đó chúng được gọi là các cực), đưa ra khái niệm điện phân (thay đổi hóa học liên quan đến dòng điện), chất điện phân (chất lỏng dẫn điện trong các tế bào điện hóa), cực dương (điện cực mà trên bề mặt của nó xảy ra phản ứng oxy hóa) và cực âm (điện cực mà trên bề mặt của nó xảy ra phản ứng khử). Các hạt mang điện trong chất lỏng được gọi là các ion (từ có nguồn gốc Hy Lạp); các ion di chuyển đến cực dương (điện cực dương) được gọi là các anion và các cation là các ion di chuyển đến cực âm (điện cực âm). Chất keo và chất rắn lơ lửng cũng có thể tham gia vào quá trình dịch chuyển các điện tích; tuy nhiên, do tính di động thấp, chúng chỉ có thể mang một phần điện tích đáng kể của dòng điện.
Đương lượng điện hóa hoàn toàn có thể được sử dụng để giám sát lượng chất phản ứng trong những quy trình xảy ra tại những điện cực, như hòa tan sắt kẽm kim loại tại cực dương, hóa khí ở cực âm và những mẫu sản phẩm của quy trình oxi hóa khử. Giá trị đương lượng điện hóa của cùng một chất hoàn toàn có thể khác nhau tùy thuộc vào quy trình điện hóa mà chất đó tham gia. Chúng ta hãy xem xét ba phản ứng khác tại cực dương .
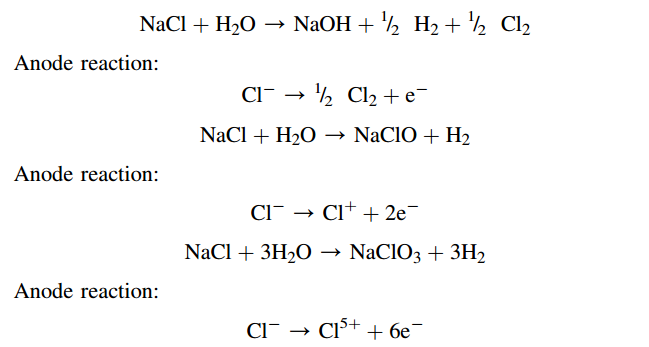 Như hoàn toàn có thể thấy từ phản ứng tại cực dương, số lượng electron tham gia vào quy trình hình thành điện phân của clo, hypochlorite và chlorate tương tự với 1, 2 và 6 electron, có nghĩa là giá trị tương ứng của z = 1, 2 hoặc 6. Do đó, đương lượng điện hóa của NaCl so với sự hình thành clo, hypochlorite và chlorate bằng z = 58,44 / ( 1 × 96,485 ) = 6,1 × 104 g / C = 0,61 mg / C ; 0,3 mg / C ; và 0,1 mg / C, tương ứng .
Như hoàn toàn có thể thấy từ phản ứng tại cực dương, số lượng electron tham gia vào quy trình hình thành điện phân của clo, hypochlorite và chlorate tương tự với 1, 2 và 6 electron, có nghĩa là giá trị tương ứng của z = 1, 2 hoặc 6. Do đó, đương lượng điện hóa của NaCl so với sự hình thành clo, hypochlorite và chlorate bằng z = 58,44 / ( 1 × 96,485 ) = 6,1 × 104 g / C = 0,61 mg / C ; 0,3 mg / C ; và 0,1 mg / C, tương ứng .
Định luật Faraday được tuân thủ khắt khe. Những xô lệch quan sát được từ những định luật Faraday, thường tương quan đến sự hiện hữu của những phản ứng điện hóa song song không được thống kê giám sát, như phản ứng với oxy, hình thành hydro peroxide hoặc phản ứng ngược chiều tạo lại loại sản phẩm khởi đầu. Những rơi lệch so với định luật Faraday trong những mạng lưới hệ thống công nghiệp hoàn toàn có thể do sự tỏa nhiệt, do hình thành những mẫu sản phẩm phụ không mong ước khác hoặc do tiêu tốn nguyên vật liệu, v.v. Sự chênh lệch của tỷ suất loại sản phẩm thu được / mẫu sản phẩm tiêu tốn giữa trong thực tiễn và triết lý thống kê giám sát dựa trên định luật Faraday thường tương quan đến những quy trình tiến độ công nghệ tiên tiến. Mối quan hệ này được gọi là hiệu suất của dòng điện ( CE – hiệu suất cao faradaic hoặc coulombic ) .
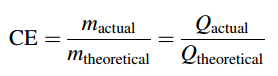
Hiệu suất của dòng điện trong các quá trình EO (Electro-oxidation) của các chất ô nhiễm hữu cơ có thể được theo dõi thông qua các giá trị phân rã COD (Chemical Oxygen Demand) ở dòng điện không đổi sử dụng phương trình.
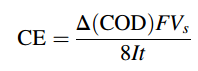 Trong đó ΔCOD là mức giảm COD trong quy trình phân hủy chất ô nhiễm tại thời gian t và 8 là khối lượng oxy tương tự ( q tương đương-1 )
Trong đó ΔCOD là mức giảm COD trong quy trình phân hủy chất ô nhiễm tại thời gian t và 8 là khối lượng oxy tương tự ( q tương đương-1 )
J. Gibbs và W. Nernst đã góp thêm phần tăng trưởng nhiệt động lực của điện hóa và đặc biệt quan trọng là xác lập thực chất của điện thế ( điện áp ) trong tế bào điện hóa và sự cân đối giữa nguồn năng lượng điện, hóa và nhiệt. Điện thế được xác lập bởi nguồn năng lượng của những quy trình hóa học xảy ra trong những tế bào điện hóa và cũng phụ thuộc vào vào động học của chúng .
Nguồn : S. Mika, S. Marina. Electrochemical Water Treatment Methods Fundamentals, Methods and Full Scale Applications. Butterworth-Heinemann, pages 15 – 18, 2017 .
Source: https://futurelink.edu.vn
Category: Tin tổng hợp