Bạn đang đọc: ✅ CÔNG THỨC HÓA 10 ⭐️⭐️⭐️⭐️⭐️
3.7 / 5 – ( 4 bầu chọn )
Chương 1,2. Nguyên tử – Bảng tuần hoàn hóa học














Các công thức tính toán


Các công thức Hóa Học lớp 10 Hk1 Hk2 đầy đủ
Chương trình hóa học lớp 10
- Chương 1: Nguyên Tử
- Chương 2: Bảng Tuần Hoàn Các Nguyên Tố Hóa Học Và Định Luật Tuần Hoàn
- Chương 3: Liên Kết Hóa Học
- Chương 4: Phản Ứng Oxi Hóa Khử
- Chương 5: Nhóm Halogen
- Chương 6: Oxi – Lưu Huỳnh
- Chương 7: Tốc Độ Phản Ứng Và Cân Bằng Hóa Học
Chương 1: Nguyên tử
Số đơn vị chức năng điện tích hạt nhân = số proton = số electron. Z = P = E
Số khối A của hạt nhân : là tổng số proton Z và số nơtron N. A = Z + N
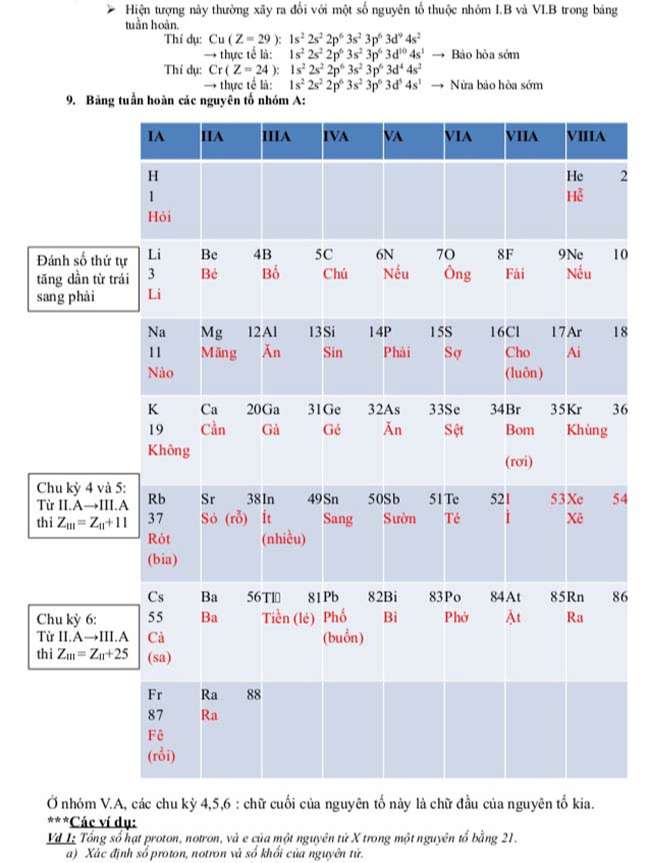
Chương 2: Bảng tuần hoàn và định luật tuần hoàn các nguyên tố hóa học
Chương này những em đa phần tính toán số proton, nowtron, electron của nguyên tử và tính Tỷ Lệ .
Chương 3: Liên kết hóa học
Ta có :
Thể tích của nguyên tử là Vmol
Tính thể tích của 1 nguyên tử :
Thể tích thực là : Vt = V. 74
Từ công thức ta tìm được R là nửa đường kính nguyên tử .
Chương 4: Phản ứng oxi hóa-khử
Cân bằng phương trình oxi hóa-khử bằng chiêu thức cân đối electron. Chương này gồm 2 dạng bài chính :
Dạng 1 : Phản ứng oxi hóa – khử không có thiên nhiên và môi trường
Dạng 2 : Phản ứng oxi hóa – khử có môi trường tự nhiên
Chương 5: Nhóm Halogen
Phương pháp trung bình : Với hợp chất muối MX ta có : mMX = mM + mX
Phương pháp bảo toàn nguyên tố : Ví dụ ta có nCl = nhCl = 2 nh2
Phương pháp tăng giảm khối lượng : Thường dựa vào khối lượng sắt kẽm kim loại phản ứng
Chương 6: Nhóm Oxi
Bài tập xác lập thành phần hỗn hợp
Trường hợp xác lập % khối lượng những chất A, B, C trong hỗn hợp .
Cách giải :
Gọi x, y, z lần lượt là số mol của những chất A, B, C trong hỗn hợp
– > mhh = xA + yB + zC ( 1 )
Tuỳ theo dữ kiện đề bài ta tìm được å x + y +z (2)
Từ ( 1 ) và ( 2 ) lập phương trình toán học => đại lượng cần tìm .
Trường hợp xác lập % theo thể tích
Cách giải :
Giả sử hỗn hợp gồm 2 khí A, B
X là số mol khí A g số mol khí B là ( 1 – x ) wsng với một hỗn hợp khí .
Chương 7: Tốc độ phản ứng và cân bằng hóa học
Biểu thức tốc độ phản ứng :
Xét phản ứng : mA + nB → pC + qD
Biểu thức tốc độ : v = k. ( A ) m. ( B ) n
Với k là hằng số tỉ lệ ( hằng số tốc độ
( A ), ( B ) là nồng độ mol chất A, B .
Tổng hợp kiến thức Hóa học lớp 10
Chương trình Hóa học 10 gồm có 6 nhóm kỹ năng và kiến thức quan trọng :
- Nguyên tử – Bảng tuần hoàn các nguyên tố hóa học
- Nhóm Halogen
- Nhóm oxi
- Tốc độ phản ứng và cân bằng hóa học
- Liên kết hóa học- Phản ứng hóa học- Nhận biết
- Bài toán H+, NO3-
Phần tóm tắt lý thuyết Nguyên tử- Bảng tuần hoàn nguyên tố hóa học
Nguyên tử

Thành phần cấu trúc nguyên tử : Hạt nhân ( Proton + Nơtron ) + Vỏ nguyên tử ( Electron )
Electron:
me = 9,1094. 10-31 kg
qe = – 1,602. 10-19 C kí hiệu là – eo qui ước bằng 1 –
Proton mang điện tích + : Kí hiệu P
m = 1,6726. 10-27 kg
q = + 1,602. 10-19 C kí hiệu eo, qui ước 1 +
Nơtron: Không mang điện, khối lượng gần bằng P
- Kích thước & khối lượng nguyên tử
Kích thước : 1A = 10-10 m = 10-8 cm
1 nm = 10-9 m ; 1 nm = 10A. Đơn vị tính A thường dùng nm .
Khối lượng :
Khối lượng của nguyên tử tính bằng U
1 u = 1/12 khối lượng 1 nguyên tử đồng vị cacbon-12
1 u = 19,9265. 10-27 kg / 12 = 1,6605. 10-27 kg
- Hạt nhân nguyên tử
- Điện tích của hạt nhân:
- Điện tích của Proton: +1. Hạt nhân có Z proton thì điện tích là Z+
- Đơn vị điện tích hạt nhân: Số P= số e.
Ví dụ Na có Z = 11 + => Na có số đơn vị chức năng điện tích hạt nhân là 11 p, 1 e .
Số khối :
- Số khối của nguyên tử là tổng số P và N
A = Z + N
Nguyên tử khối = P + N
Bảng tuần hoàn nguyên tố hóa học

- Nguyên tắc sắp xếp:
- Các nguyên tố hóa học được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử
- Các nguyên tố có cùng số e trong nguyên tử xếp thành 1 hàng
- Các nguyên tố có cùng số e hóa trị trong nguyên tử xết thành 1 cột
- Cấu tạo của bảng tuần hoàn
Ô số nguyên tố : Số thứ tự của ô bằng với số hiệu của nguyên tử
Chu kỳ : Chu kỳ nhỏ ( 1,2,3 ) ; chu kỳ luân hồi lớn ( 4,5,6,7 ). Là dãy những nguyên tố có cùng lớp e được xết theo chiều điện tích hạt nhân tăng dần. Số thứ tự của những chu kỳ luân hồi trùng với số lớp e của nguyên tử những nguyên tố trong chu kỳ luân hồi đó .
Nhóm nguyên tố : s, p, d, f .
Source: https://futurelink.edu.vn
Category: Tin tổng hợp